2023年11月Cell期刊精华
来源:生物谷原创 2023-11-30 14:21
2023年11月份即将结束,11月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年11月份即将结束,11月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
doi:10.1016/j.cell.2023.10.009
在一项新的研究中,德国马克斯普朗克多学科科学研究所结构动力学系主任Holger Stark和马克斯普朗克多学科科学研究所结构生物化学与机理研究组组长Ashwin Chari领导的一个研究团队首次以前所未有的分辨率(1.9埃米)解析了酵母脂肪酸合酶(fatty acid synthase, FAS)的三维结构。相关研究结果发表在2023年11月9日的Cell期刊上,论文标题为“Reconstruction of a fatty acid synthesis cycle from acyl carrier protein and cofactor structural snapshots”。
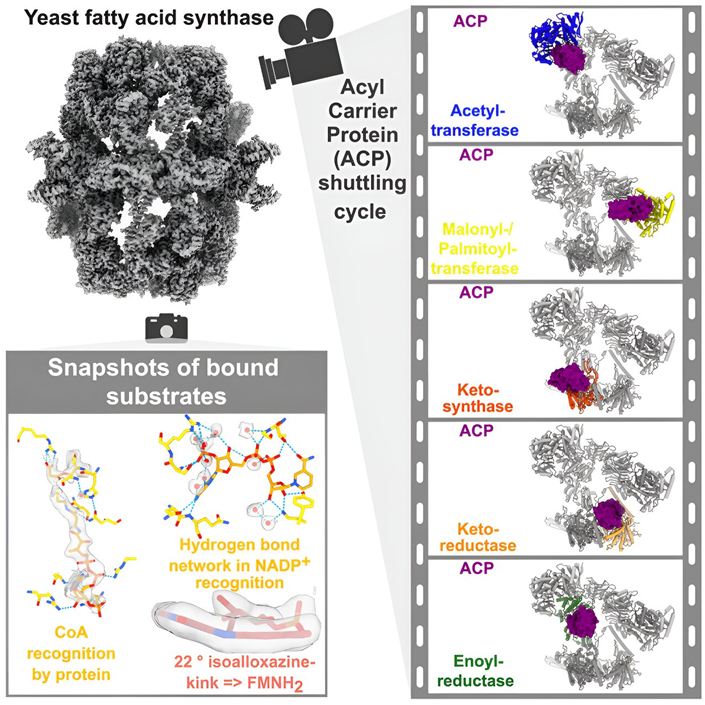
图片来自Cell, 2023, doi:10.1016/j.cell.2023.10.009。
这些作者还拍摄了酵母FAS 的工作过程,并重建了一个完整的脂肪酸生物合成循环。为此,他们采用了多种方法来跟踪酰基载体蛋白(acyl carrier protein, ACP)穿过酵母FAS 迷宫的过程。起初,他们在试管中启动脂肪酸的生物合成,并在不同时间段后通过快速冷冻酵母FAS 分子来阻止它的活动,这样就能使酵母FAS 处于不同的脂肪酸生物合成状态。
然后,他们利用低温电镜对酵母FAS的脂肪酸生物合成周期的快照进行成像。Chari说,“找到底物的精确组合和数量,使酵母FAS 在脂肪酸生物合成周期的关键点停止下来,是一项重大的技术挑战。只有在所有相关步骤切换都能可视化观察并通过模型准确描述的情况下,我们才能重建整个脂肪酸的生物合成循环。”
2.两篇Cell+5篇Cell子刊首次成功在实验室中制造出合成基因组超过50%的酵母菌株
doi:10.1016/j.cell.2023.09.025; doi:10.1016/j.cell.2023.10.015
来自美国纽约大学、约翰霍普金斯大学、英国曼彻斯特大学、爱丁堡大学和德国欧洲分子生物学实验室和中国华大基因的研究人员将在实验室里制作的七条以上的合成染色体组合到一个酵母细胞中,得到了一种含有50%以上合成DNA的酵母菌株,它的存活和复制能力与野生酵母菌株相似。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.09.025。
相关研究成果于2023年11月8日以7篇论文的形式发表,其中2篇发表在Cell期刊上,论文标题分别为“Debugging and consolidating multiple synthetic chromosomes reveals combinatorial genetic interactions”和“Design, Construction, and Functional Characterization of a tRNA Neochromosome in Yeast”;4篇发表在Cell Genomics期刊上,论文标题分别为“Dissecting aneuploidy phenotypes by constructing Sc2.0 chromosome VII and SCRaMbLEing synthetic disomic yeast”、“Consequences of a telomerase-related fitness defect and chromosome substitution technology in yeast synIX strains”、“Rise of synthetic yeast: Charting courses to new applications”和“A spotlight on global collaboration in the Sc2.0 yeast consortium”;1篇发表在Molecular Cell期刊上,论文标题为“Manipulating the 3D organization of the largest synthetic yeast chromosome”。
这些论文展示了合成酵母基因组计划(Synthetic Yeast Genome Project)Sc2.0,即一个致力于从头开始开发首个合成真核生物基因组的全球联盟。这些作者如今合成并调试了全部十六条酵母染色体。
曼彻斯特大学合成生物学家 Yizhi Cai 说,“我们的动机是通过构建合成基因组来了解基因组的基本原理。我们如今重写了酿酒酵母(Saccharomyces cerevisiae)的操作系统(即基因组),这开启了工程生物学的新纪元---从修补少量基因到从头设计和构建整个基因组。”
3.Cell:揭示哺乳动物卵细胞储存早期胚胎发育所需的蛋白机制
doi:10.1016/j.cell.2023.10.003
哺乳动物生育后代时,它们会投入很多。与鱼或青蛙不同,胚胎无法自行发育。它必须植入子宫,并在那里获得生存所需的一切。在此之前,卵细胞一直在为早期胚胎提供营养。除其他外,它还提供必需的蛋白。
在一项新的研究中,德国马克斯-普朗克多学科科学研究所的 Melina Schuh 领导的研究人员与哥廷根大学的同事一起,阐明了卵细胞是如何储存蛋白的。他们的实验还为了解蛋白储存错误如何导致不孕症提供了重要启示。令科学家们困惑了60多年的卵细胞结构在其中发挥了至关重要的作用。相关研究结果于2023年11月2日在线发表在Cell期刊上,论文标题为“Mammalian oocytes store proteins for the early embryo on cytoplasmic lattices”。
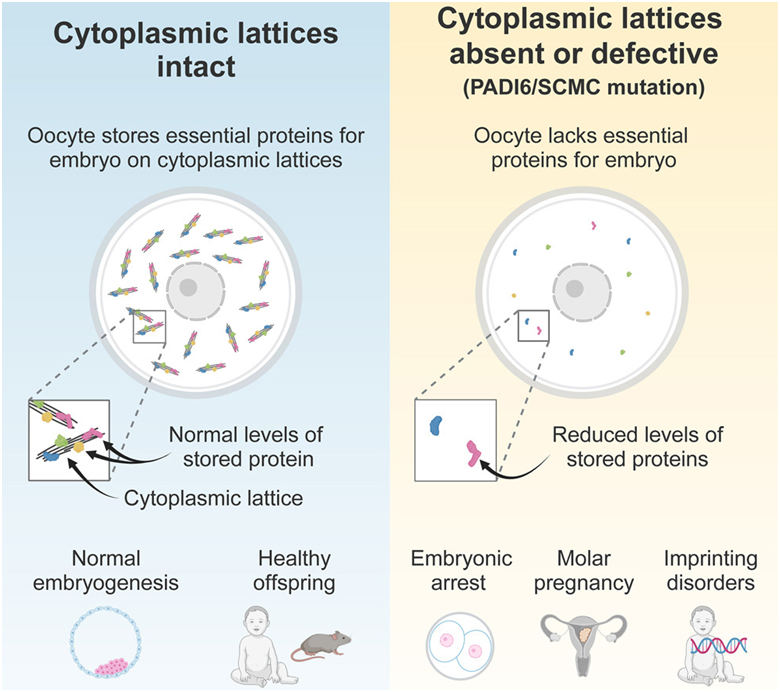
图片来自Cell, 2023, doi:10.1016/j.cell.2023.10.003。
对全球不孕女性遗传物质的分析表明,导致女性不孕的最常见遗传原因之一是某些基因的突变。这些基因包含制造蛋白 PADI6 和称为皮质下母体复合体(Subcortial Maternal Complex, SCMC)的蛋白复合体的蓝图。然而,人们以前并不清楚这些蛋白在不孕症中的具体作用。
Schuh及其研究团队如今利用成像技术可视化观察到,PADI6 和 SCMC 是填充卵细胞内部结构的主要成分。Schuh解释说,“几十年来,研究界一直在困惑这种结构的功能和组成,我们称其为细胞质晶格(cytoplasmic lattices)。”
当这些作者从小鼠卵细胞中移除 PADI6 和 SCMC 蛋白时,细胞质晶格消失了---这带来了致命的后果。Schuh说,“缺乏细胞质晶格的小鼠卵细胞也缺乏早期胚胎所需的蛋白。胚胎的发育在受精后不久就停止了。因此,我们猜测细胞质晶格可能是蛋白的储存场所。”
在卵细胞中储存蛋白绝非易事。这是因为卵细胞是在雌性哺乳动物出生后的卵巢中产生的,并在卵巢中保持数月甚至数年的功能性。卵细胞必须在相应长的时间内储存蛋白,使之不被降解或在错误的时间变得活跃。
接下来,Schuh团队研究了细胞质晶格中含有哪些蛋白。他们与马克斯-普朗克多学科科学研究所的Henning Urlaub和Juliane Liepe领导的研究团队合作,利用质谱法和生物信息学确定了细胞质晶格中的确切蛋白含量。
他们的结果显示,细胞质晶格与许多对胚胎发育至关重要的蛋白结合。Schuh指出,“我们的结果有力地证明了我们的假设是正确的:细胞质晶格是卵细胞的蛋白储存场所,为早期胚胎提供重要的蛋白。”
4.Cell:我国科学家在世界上培育出首个胚胎干细胞嵌合体猴子
doi:10.1016/j.cell.2023.10.005
在一项新的研究中,来自中国多个研究机构的研究人员报道了一只猴子的活产,这只猴子体内含有大量来自猴子胚胎干细胞系的细胞。这只“嵌合体”猴子是由来自同一个猴子物种的两个基因不同的胚胎的细胞组成。这一点之前之前在大鼠和小鼠身上得到证实,但是在此之前,还没有在包括非人灵长类动物在内的其他物种身上得到证实。相关研究结果发表在2023年11月9日的Cell期刊上,论文标题为“Live birth of chimeric monkey with high contribution from embryonic stem cells”。
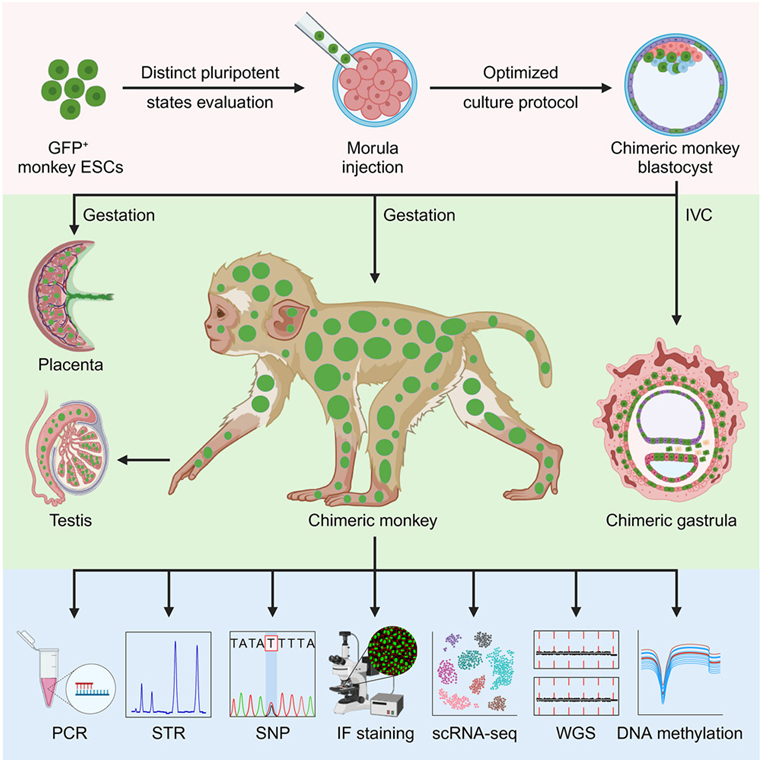
图片来自Cell, 2023, doi:10.1016/j.cell.2023.10.005。
论文共同通讯作者、中国科学院神经科学研究所研究员刘真(Zhen Liu)说,“这是该领域长期追求的目标。这项新的研究不仅对了解包括人类在内的其他灵长类动物的原始态多能性(naive pluripotency)有意义,而且对基因工程和物种保护也有相关的现实意义。具体来说,这项新研究可能帮助我们生成更精确的猴子模型,用于研究神经系统疾病以及其他生物医学研究。”
这项新研究中使用的猴子是食蟹猴或长尾猴,是生物医学研究中常见的灵长类动物。这些作者首先利用从七天大的囊胚中取出的细胞建立了九个胚胎干细胞系。然后,他们将这些胚胎干细胞系放入培养液中培养,以增强它们分化成不同细胞类型的能力。
他们对这些胚胎干细胞进行了一系列不同的测试,以确认它们具有多能性,即能够分化成制造活体动物所需的所有细胞类型。这些胚胎干细胞还被标记上绿色荧光蛋白标签,这样他们就能确定在任何发育和存活的动物中,哪些组织是由这些胚胎干细胞生长出来的。最终,他们选择了其中的一部分胚胎干细胞,将它们注入早期猴子桑椹胚(胚胎4至5天大)中。这些桑椹胚随后被植入雌性猴子体内,结果有12只雌性猴子怀孕,6只活产。
他们的分析证实一只活着出生的猴子和一个流产的胎儿基本上是嵌合的,它们全身都含有由胚胎干细胞产生的细胞。这两者的性别均为雄性。他们使用绿色荧光蛋白标签来确定哪些组织含有由植入的胚胎干细胞产生的细胞。他们还利用基因测序和其他测试来自确认不同器官中存在胚胎干细胞衍生组织。
他们测试的含有胚胎干细胞衍生细胞的组织类型包括大脑、心脏、肾脏、肝脏和胃肠道。在这只活着出生的猴子体内,植入的胚胎干细胞在不同组织类型中的贡献率从21%到92%不等,在26种不同类型的组织中,平均贡献率为67%。这个流产的猴子胎儿中相应的贡献率较低。在这只活着出生的猴子和这个流产的猴子胎儿中,他们还证实了睾丸和最终发育成精子的细胞中存在胚胎干细胞衍生细胞。
5.Cell:我国科学家开发出神经回路特异性的基因疗法逆转帕金森病中的核心运动症状,为未来成功治疗帕金森病奠定基础
doi:10.1016/j.cell.2023.10.004
在一项新的研究中,来自中国科学院深圳先进技术研究院的研究人员及其合作者开发出一种基因治疗策略,可选择性地操纵受帕金森病影响的神经回路,从而在啮齿类动物和非人灵长类动物中减轻帕金森病的核心运动症状。相关研究结果于2023年11月2日在线发表在Cell期刊上,论文标题为“Circuit-specific gene therapy reverses core symptoms in a primate Parkinson’s disease model”。
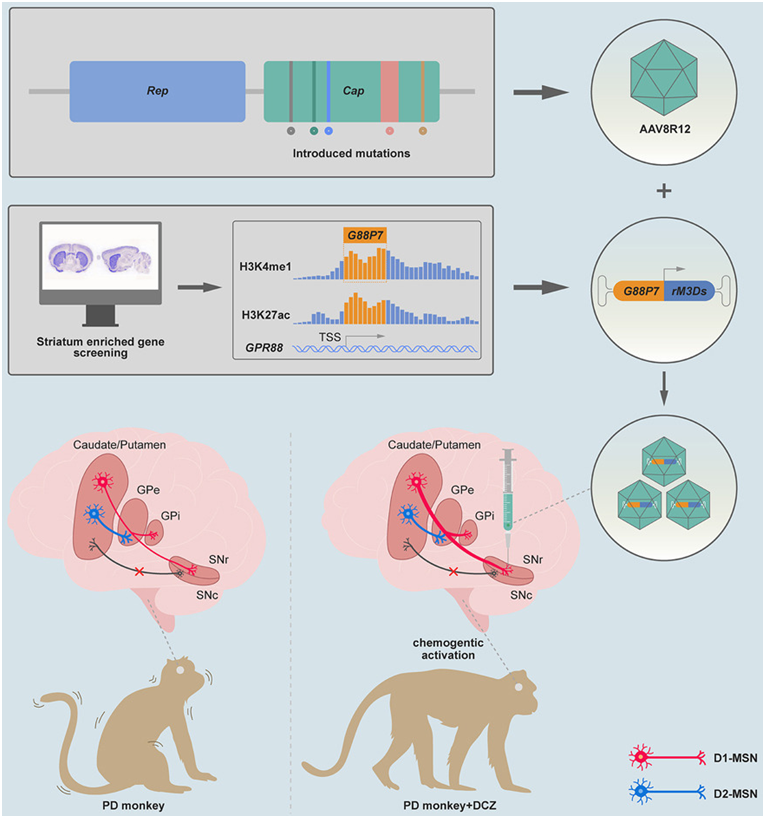
图片来自Cell, 2023, doi:10.1016/j.cell.2023.10.004。
由于黑质网状部接受来自D1-MSN的密集投射,而没有接受来自D2-MSN的投射,这些作者提出,可以通过向黑质网状部注射高效逆向腺相关病毒(adeno-associated virus, AAV)来选择性标记D1-MSN,然后通过在这种逆向AAV中引入神经元活动调节元件来专门操纵D1-MSN。
为了实现上述目标,他们开发了一种新型 AAV衣壳AAV8R12,用于对纹状体中的 D1-MSN 进行高效逆向标记,还开发了一种新的启动子 G88P2/3/7,具有很强的 D1-MSN 活性。这种基因治疗策略利用化学效应物rM3D配合全身给送的激活药物,能够特异性激活D1-MSN,从而驱动D1-MSN介导的直接通路。
在帕金森病灵长类动物模型中,给送这种靶向 D1-MSN 的神经回路特异性基因疗法后,运动迟缓、僵硬和震颤等典型运动症状得到了极大改善。例如,运动迟缓大大减少,震颤完全消失,运动技能得到恢复。
6.Cell:新研究表明CAAR-T细胞疗法有望治疗自身免疫性脑炎
doi:10.1016/j.cell.2023.10.001
在一项新的研究中,来自德国神经退行性疾病研究中心和柏林夏里特医学院的研究人员开创了一种治疗称为NMDA受体脑炎(NMDA receptor encephalitis)的最常见自身免疫性脑炎的新型疗法。通过对称为T细胞的白细胞进行重编程,使之靶向消除致病细胞,这种方法的精确度和效率都达到了新的水平。它已在实验室研究中获得成功,目前正在计划进行人体临床试验。相关研究结果于2023年11月1日在线发表在Cell期刊上,论文标题为“Chimeric autoantibody receptor T cells deplete NMDA receptor-specific B cells”。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.10.001。
NMDA受体脑炎是抗体引起的脑部疾病中最常见的一种。在这种疾病中,抗NMDA受体抗体会突然攻击大脑,从而转而攻击患者自己的身体。论文共同通讯作者Harald Prüss教授说,“在临床前实验中,我们成功地选择性关闭了形成这些错误靶向抗体(抗NMDA受体抗体)的B细胞。”
这些作者设计了专门的嵌合自身抗体受体(chimeric autoantibody receptor, CAAR)T细胞(CAAR-T),用于注射到患者体内。这些经过编程的CAAR-T细胞能高精度地识别并清除产生抗NMDA受体抗体的B细胞。在小鼠模型中,这种创新方法展示了它的准确性。
7.Cell:发现一些分离出的广泛中和人类抗体有望治疗耐药性铜绿假单胞菌
doi:10.1016/j.cell.2023.10.002
铜绿假单胞菌(Pseudomonas aeruginosa)具有多种抗药性机制,它导致的发病率和死亡率都很高,并可能导致重症患者出现复杂的感染和危险的败血症病例。
在一项新的研究中,来自德国科隆大学、科隆大学医院、亥姆霍兹感染研究中心和汉堡大学医院的研究人员从慢性病患者的免疫细胞中分离出了一些抗体,这些抗体可能会成为治疗铜绿假单胞菌急性和慢性感染的新方法。他们还描述了这些抗体的结合机制。相关研究结果于2023年11月1日在线发表在Cell期刊上,论文标题为“Discovery of highly neutralizing human antibodies targeting Pseudomonas aeruginosa”。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.10.002。
因此,在这项新的研究中,这些作者研究了分离广泛中和人类抗体的方法(这种方法在治疗病毒感染方面取得了成功)是否也能用于开发针对细菌感染的新疗法。论文共同第一作者兼论文共同通讯作者、科隆大学医院的Alexander Simonis博士说,“许多已经用于抗病毒的治疗性抗体都是从感染者、康复者或接种过疫苗的人身上分离和开发出来的。”
这些作者从长期感染铜绿假单胞菌的囊性纤维化患者的免疫细胞中分离出了靶向这种病原菌的高效抗体。这些抗体能阻断该细菌的一种重要毒力因子,即所谓的 III 型分泌系统,该分泌系统在严重感染铜绿假单胞菌时发挥着重要作用。
在使用细胞培养物和动物模型进行的大量实验中,这些作者证实这些新开发的抗体与传统抗生素一样有效。不过,由于这些抗体的活性与抗生素的作用机制和耐药性无关,因此与许多传统抗生素相比,这些所谓的“病理阻断剂(pathoblocker)”也能对高度耐药细菌起作用。
8.Cell:双管齐下靶向SWI/SNF和EP400可有效抑制癌细胞生长,有望开发出更好的癌症疗法
doi:10.1016/j.cell.2023.10.006
癌细胞通常发生一系列突变。大约20%到25%的癌症涉及一种名为SWI/SNF的分子复合物发生突变。然而,旨在阻断SWI/SNF活性的药物并不总是像预期的那样有效。如今,在一项新的研究中,来自美国哈佛医学院的研究人员找到了原因。他们发现,当用药物阻断SWI/SNF时,第二种分子会挺身而出进行补偿;在阻断SWI/SNF的同时阻断第二种分子可抑制实验室培养皿中癌细胞的生长,这表明这种双药物组合疗法可能对癌症患者更有效。相关研究结果于2023年11月2日在线发表在Cell期刊上,论文标题为“Global identification of SWI/SNF targets reveals compensation by EP400”。
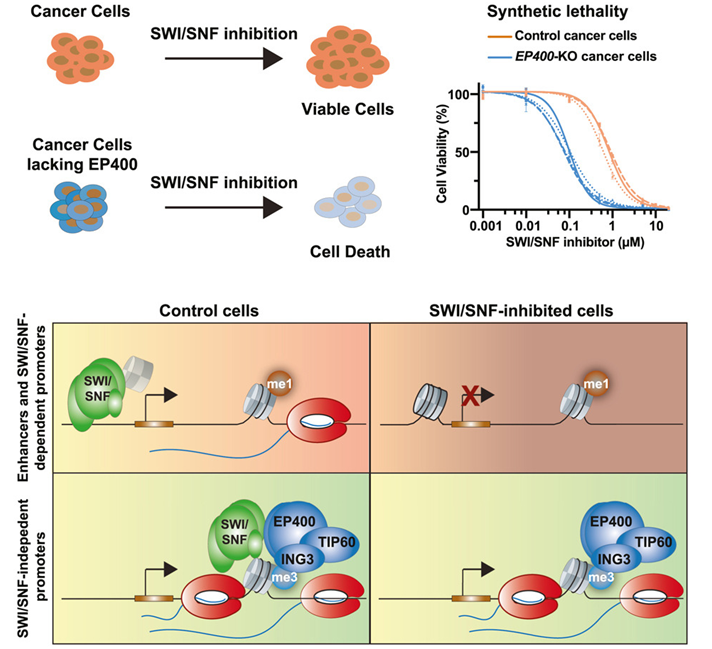
图片来自Cell, 2023, doi:10.1016/j.cell.2023.10.006。
论文通讯作者、哈佛医学院布拉瓦特尼克研究所生物化学与分子药理学教授Karen Adelman说,“我对这项新研究感到兴奋,因为它为治疗SWI/SNF复合物发生突变的癌症指明了另一条道路。”她说,“这项研究有趣而有意义的地方在于,它表明一种一举两得的双药物组合疗法对抑制这些癌细胞可能真地很有用。”
这些作者是通过解答 SWI/SNF 在健康细胞和癌细胞中的确切作用方式而获得这一发现的。Adelman说,“如果你确切了SWI/SNF复合物在正常细胞中的作用,你就能找到其他漏洞,从而知道如何更好地杀死癌细胞。了解基本机制确实有助于开发更好的治疗策略。”
在人体细胞中,DNA被紧紧包裹成一种叫做染色质的形式,看起来就像一串微小的念珠。称为染色质重塑剂的多种分子会在不同的位置解开染色质,暴露出某些基因,以便使用它们,然后重新包装染色质,把基因重新藏起来。
SWI/SNF 就是这样一种染色质重塑剂。人们已知道,它能在染色质上的念珠---核小体---周围移动,让核小体前后滑动,有时甚至将它们一并摘下,以控制基因的访问。人们之前认为SWI/SNF疗法通过阻止突变的SWI/SNF复合物为基因提供不适当的访问途径,就可抑制癌症驱动基因的活性。
论文共同第一作者、Adelman实验室生物化学与分子药理学研究员Benjamin Martin和当时还是哈佛大学生物与生物医学科学项目博士生的Eileen Ablondi发现,事情并没有那么简单。阻断SWI/SNF只能抑制一部分基因的活性。
这些作者发现,当他们抑制 SWI/SNF 时,起初所有基因都关闭了。他们进一步探究后发现,另一种分子 EP400 会发挥作用,恢复基因访问。只有同时阻断 SWI/SNF 和 EP400,他们才能成功抑制异常的基因活性。
doi:10.1016/j.cell.2023.09.028
在一项新的研究中,来自德国马克斯-普朗克大脑研究所的研究人员重塑了人们对大脑基本组成部---存在于突触中的蛋白---的认识。他们深入探讨了神经元之间的重要连接---突触---的复杂世界。相关研究结果于2023年11月1日在线发表在Cell期刊上,论文标题为“The proteomic landscape of synaptic diversity across brain regions and cell types”。
科学家们早就知道有不同类型的突触,但造成突触多样性的特定蛋白组合一直是个谜。了解驱动不同突触功能的不同蛋白组合,对于破译大脑功能以及疾病过程中出现的问题至关重要。
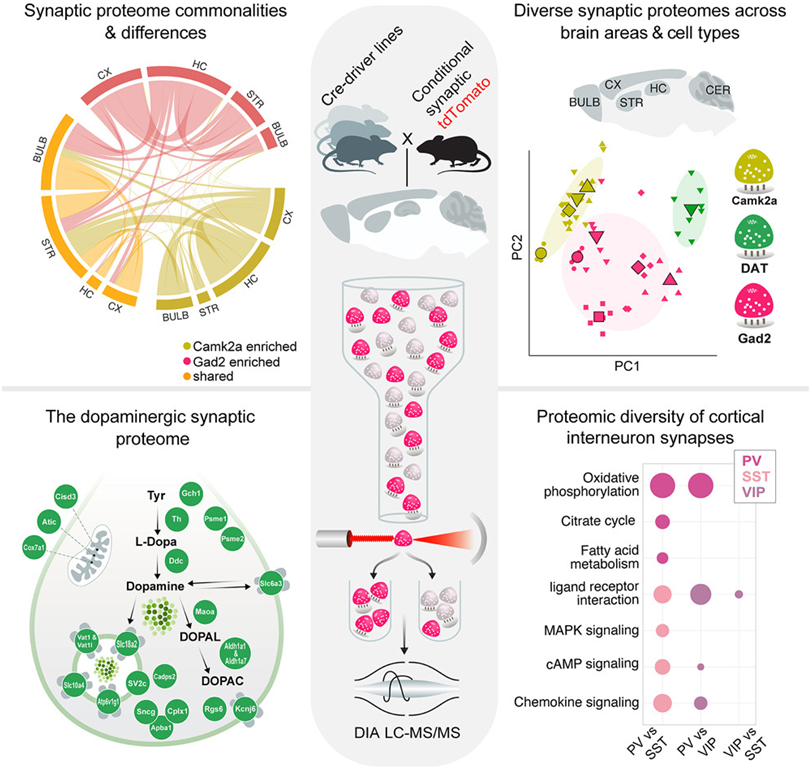
图片来自Cell, 2023, doi:10.1016/j.cell.2023.09.028。
为了回答哪些特定蛋白质组确定了不同类型的突触,论文通讯作者Erin Schuman及其研究团队首先从不同大脑区域的不同类型神经元中分离出突触。他们利用基因工程小鼠,在这些小鼠中,对感兴趣的突触进行荧光标记,使其得以分离和纯化。论文第一作者Marc van Oostrum等人使用定量质谱法(一种可以鉴定和定量确定单个蛋白水平的方法)分析了五个不同大脑区域中的 18 种不同突触类型。
最终,Schuman团队鉴定出了1800多种独特的突触类型丰富的蛋白,揭示了突触连接所依赖的分子的惊人多样性。van Oostrum说,“这代表着我们对突触多样性的理解有了重大飞跃。通过揭示突触错综复杂的分子结构,我们不仅扩大了对大脑功能的认识,还为神经系统疾病的研究和潜在的治疗干预开辟了新的途径。”
这项新的研究发现了存在于大多数突触中的常见突触蛋白模块,还发现了驱动突触特殊功能的特定“蛋白质组热点(proteomic hotspots)”。例如,在一类释放神经递质多巴胺的突触中,一种有助于细胞应对氧化应激的分子出现了特异性消耗。Schuman说,“鉴于多巴胺能突触容易受到氧化应激的影响,而且在帕金森病期间会丧失多巴胺能突触,我们对这一发现很感兴趣。”
doi:10.1016/j.cell.2023.09.027
溶酶体在细胞和组织中发挥着重要作用,不仅控制着物质的降解,还控制着细胞的分裂和生长。在一项新的研究中,来自德国莱布尼茨分子药学研究所、柏林自由大学和柏林夏里特医学院等研究机构的研究人员研究了这两种功能与细胞内营养物供应的关系。他们首次发现溶酶体发生了巨大变化。一种脂质信号分子在这两种状态之间起着转换作用。这一发现可能能够用于开发特异性刺激神经退行性疾病或代谢性疾病患者的细胞降解细胞内有害蛋白分子的药物。相关研究结果于2023年10月25日在线发表在Cell期刊上,论文标题为“Nutrient-regulated control of lysosome function by signaling lipid conversion”。
这些作者使用光学显微镜分析了在一到两个小时内从进食状态转换到饥饿状态的细胞中溶酶体的行为。他们这样就能以三维方式详细观察荧光标记的细胞器。
这些作者还开发了生化方法来描述这两种状态下溶酶体的特征。Haucke报告说,“我们能够看到,当食物供应发生变化时,细胞会发生急剧的转变。”在一系列复杂的级联事件中,这一过程受到脂质信号分子的控制,这些分子会诱发饥饿或进食状态。他们利用光电关联显微镜技术观察到细胞中有两类溶酶体池:小的运动的溶酶体,多位于细胞外围,起着监测站的作用;较大、较静止的溶酶体靠近细胞核,负责降解。
变化的是这两类溶酶体的比例:在营养物充足的状态下,携带活性 mTOR 复合物的小型运动溶酶体占主导地位,静态溶酶体相对较少。当细胞饥饿时,小型运动溶酶体失去了mTOR的脂质信号分子标志物,并获得了新的脂质信号分子,从而激活了溶酶体中的消化酶。
Ebner报告说,“这种反应是急性的,也就是说细胞会立即发生转变,几分钟内就能观察到最初的变化。这种从分解代谢到合成代谢的过程在一到两小时内完成。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


